- Автор Alex Aldridge [email protected].
- Public 2023-12-17 13:30.
- Последно модифициран 2025-06-01 07:36.
Ключовата разлика между реакциите от първи и втори ред е, че скоростта на реакциите от първи ред зависи от първата степен на концентрацията на реагента в уравнението на скоростта, докато скоростта на реакциите от втори ред зависи от втората степен на концентрацията член в уравнението на скоростта.
Редът на реакцията е сумата от степените, до които се повишават концентрациите на реагентите в уравнението на скоростния закон. Има няколко форми на реакции според това определение; реакции от нулев ред (тези реакции не зависят от концентрацията на реагентите), реакции от първи ред и реакции от втори ред.
Какво представляват реакциите от първа поръчка?
Реакциите от първи ред са химични реакции, чиято скорост зависи от моларната концентрация на един от реагентите, които участват в реакцията. Следователно, съгласно горната дефиниция за реда на реакцията, сумата от степените, до които се повишават концентрациите на реагентите в уравнението на скоростния закон, винаги ще бъде 1. Може да има или един единствен реагент, който да участва в тези реакции. Тогава концентрацията на този реагент определя скоростта на реакцията. Но понякога има повече от един реагент, който участва в тези реакции, тогава един от тези реагенти ще определи скоростта на реакцията.
Нека разгледаме пример, за да разберем тази концепция. В реакцията на разлагане на N2O5, той образува NO2 и O 2 газове като продукти. Тъй като има само един реагент, можем да напишем реакцията и уравнението на скоростта, както следва.
2N2O5(g) → 4NO2(g) + O 2(g)
Ставка=k[N2O5(g)]m
Тук k е константата на скоростта за тази реакция и m е редът на реакцията. Следователно, от експериментални определения, стойността на m е 1. Следователно това е реакция от първи ред.
Какво представляват реакциите от втори ред?
Реакциите от втори ред са химични реакции, при които скоростта на реакцията зависи от моларната концентрация на два от реагентите или втората степен на един реагент, участващ в реакцията. Следователно, съгласно горната дефиниция за реда на реакцията, сумата от степените, до които се повишават концентрациите на реагентите в уравнението на скоростния закон, винаги ще бъде 2. Ако има два реагента, скоростта на реакцията ще зависи от първата степен от концентрацията на всеки реагент.
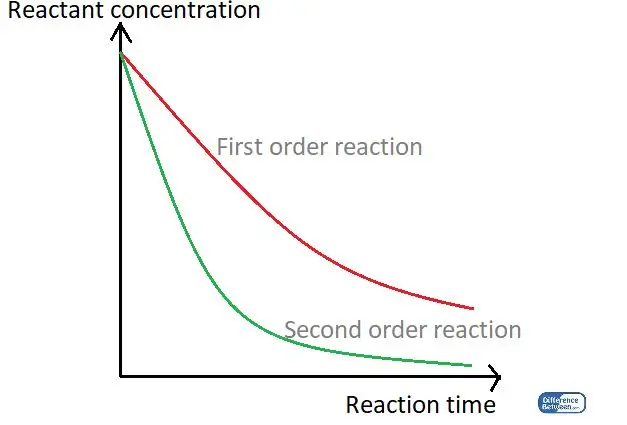
Фигура 01: Графика, сравняваща двата типа ред на реакция, използвайки тяхното време за реакция и концентрацията на реагента.
Ако увеличим концентрацията на реагент 2 пъти (ако има два реагента в уравнението на скоростта), тогава скоростта на реакцията се увеличава 4 пъти. Например, нека разгледаме следната реакция.
2A → P
Тук A е реагент, а P е продуктът. Тогава, ако това е реакция от втори ред, уравнението за скоростта на тази реакция е както следва.
Ставка=k[A]2
Но за реакция с два различни реагента, както следва;
A + B → P
Ставка=k[A]1[B]1
Каква е разликата между реакциите от първи и втори ред?
Реакциите от първи ред са химични реакции, чиято скорост зависи от моларната концентрация на един от реагентите, които участват в реакцията. Следователно, ако увеличим концентрацията на реагента 2 пъти, скоростта на реакцията се увеличава 2 пъти. Реакциите от втори ред са химични реакции, при които скоростта на реакцията зависи от моларната концентрация на два от реагентите или втората степен на един реагент, който участва в реакцията. Следователно, ако увеличим концентрацията на реагента 2 пъти, скоростта на реакцията се увеличава 4 пъти. Инфографиката по-долу представя разликата между реакции от първи и втори ред в таблична форма.

Обобщение - Реакции от първи срещу втори ред
Има три основни типа реакции според реда на реакцията; реакции от нулев, първи и втори ред. Ключовата разлика между реакции от първи и втори ред е, че скоростта на реакция от първи ред зависи от първата степен на концентрацията на реагента в уравнението на скоростта, докато скоростта на реакция от втори ред зависи от втората степен на члена на концентрацията в скоростно уравнение.






